جدول تناوبی یا جدول مندلیف، یکی از مهمترین جداول نوشته شده تاریخ بشر است. در این جدول عناصر شیمیایی بر اساس عدد اتمی (تعداد پروتونها) چیده شدهاند. با این چینش، عناصری که خواص مشابه دارند در کنار هم قرار گرفتهاند.
نظم بسیار زیبایی در این جدول برقرار است. دهها نکته میتوان ازین جدول استخراج کرد. اولین جدول تناوبی در سال ۱۸۶۹ توسط دیمیتری مندلیف نوشته شد. از آن زمان تا کنون عناصر زیادی به این جدول اضافه شدهاند. ولی کلیت جدول همان است. در همان زمان مندلیف توانست بر اساس جدول، خواص برخی از عناصر ناشناخته را هم پیشبینی کند.
در این مقاله قصد داریم نکات جدول تناوبی را شرح دهیم. پس بدون اتلاف وقت و مقدمه چینی به سراغ نکات میرویم:
نکات کلی جدول تناوبی
نکته : در جدول تناوبی عناصر بر اساس عدد اتمی یا Z مرتب شدهاند. عدد اتمی برابر است با تعداد پروتونهای هسته اتم. بنابراین ایزوتوپها در جدول تناوبی از هم جدا نمیشوند. تمام ایزوتوپهای یک اتم در جدول تحت یک نام هستند.
نکته : جدول تناوبی دارای ۱۱۸ عنصر است.
نکته : ۹۴ عنصر اول جدول تناوبی در طبیعت یافت میشوند (در شیمی ۲، ۹۱ عنصر ذکر شده است). ۲۴ عنصر دیگر (از ۹۵ تا ۱۱۸) در آزمایشگاه ساخته شدهاند.
نکته : از ۹۴ عنصری که در طبیعت یافت میشوند، ۸۴ عدد پایدارند. ۱۰ عنصر دیگر در طی فرآیند شکست عناصر دیگر به وجود میآیند و ناپایدارند.
نکته : تا کنون هیچ عنصر سنگینتر از اینستنیم (عنصر ۹۹) در ابعاد ماکروسکوپیک و مقدار زیاد دیده نشده است. عناصر استاتین (۸۵) و فرانسیم (۸۷) هم تنها به صورت نور ساطع در زیر میکروسکوپ دیده شدهاند.
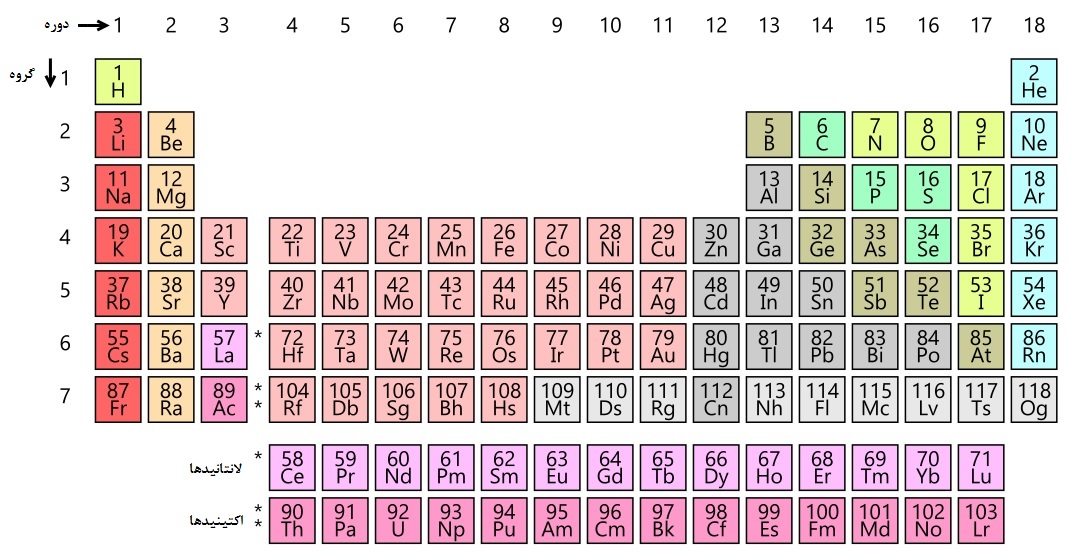
گروهها در جدول تناوبی
نکته : ستونهای جدول تناوبی را گروه مینامند.
نکته : عناصری که در یک گروه قرار دارند، دارای خواص شیمیایی مشابه هستند. زیرا آرایش الکترونی آنها شبیه به هم است. یعنی تعداد الکترونهای لایهی آخر آنها یکسان است.
نکته : تعداد ۱۸ گروه در جدول تناوبی وجود دارد. شمارهگذاری از سمت چپ به راست است. نام و خواص گروهها به ترتیب زیر است (از ستون سمت چپ جدول به راست):
- گروه یک، فلزات قلیایی: این گروه یک الکترون در لایه آخر دارند. با از دست دادن یک الکترون به آرایش گازهای نجیب میرسند. بسیار واکنش پذیرند. بسیار نرم هستند. در تماس با آب به شدت واکنش داده و محلول بازی تولید میکنند.
- گروه دو، فلزات قلیایی خاکی: دارای دو الکترون در اوربیتال بیرونی هستند. واکنشپذیری کمتری نسبت به فلزات قلیایی دارند. سختتر و چگالتر از فلزات قلیایی هستند.
- گروه سه تا دوازده، فلزهای واسطه: همگلی فلز هستند. واکنشپذیری کمتری نسبت به قلیایی خاکی دارند. بینظمیهای زیادی در آرایش الکترونی و خواص آنها دیده میشود.
- گروه ۱۳ تا ۱۶: در این گروهها برخی فلز، برخی نافلز و برخی شبه فلز هستند.
- گروه ۱۷، هالوژنها: این گروه همگی نافلزند و تنها یک الکترون در لایه آخر کم دارد. به شدت واکنشپذیرند و با فلزهای قلیایی تشکیل نمک میدهند. در واکنش با هیدروژن تشکیل اسید میدهند. با حرکت از بالا به پایین در هالوژنها، واکنشپذیری آنها کاهش مییابد زیرا شعاع اتم زیاد میشود.
- گروه ۱۸، گازهای نجیب: این گروه آرایش الکترونی کاملی دارند. تمایل آنها به واکنش کم است.
تناوب در جدول تناوبی
نکته : سطرهای جدول تناوبی را دوره مینامند.
نکته : یک دوره جدید زمانی شروع میشود که یک لایه الکترونی اولین الکترون خود را بگیرد.
نکته : جدول تناوبی به چهار دسته تقسیم میشود:
دسته اول: این دسته شامل فلزات قلیایی، قلیایی خاکی، هیدروژن و هلیم است و آن را دسته s مینامند. زیرا در تمامی عناصر این دسته، آخرین لایه الکترونی، s است.
دسته دوم: این دسته شامل شش گروه آخر است. یعنی از گروه ۱۳ تا ۱۸٫ این دسته را p مینامند. در تمامی عناصر این دسته، آخرین لایه الکترونی، p است.
دسته سوم: این دسته گروههای ۳ تا ۱۲ را شامل میشود. به این دسته d یا فلزات واسطه میگویند. در تمامی عناصر این دسته، آخرین لایه الکترونی، d است.
دسته چهارم: این دسته شامل دو ردیف جدا شده در پایین جدول است. ردیف اول را لانتانیدها و ردیف دوم را اکتینیدها مینامند. نام این دسته f است. این دسته شماره گروه ندارد. در تمامی عناصر این دسته، آخرین لایه الکترونی، f است.
روند تغییر الکترونگاتیوی در جدول تناوبی
الکترونگاتیوی یعنی تمایل یک اتم برای جذب الکترون. الکترونگاتیوی به صورت نسبی سنجیده میشود. بیشتری الکترونگاتیوی مربوط به فلوئور است و آن را ۴ میگیرند. الکترونگاتیوی سایر عناصر را با توجه به فلوئور تعیین میکنند.
نکته : در یک گروه، هر چه از بالا به پایین حرکت کنیم، الکترونگاتیوی اتمها کاهش مییابد. زیرا فاصله الکترون آخر از هسته اتم بیشتر شده و در نتیجه کشش هسته روی آن کمتر است. پس از دست دادن این الکترون راحتتر میشود.
نکته : در یک دوره از چپ به راست، الکترونگاتیوی اتمها افزایش مییابند. زیر لایه آخر کاملتر میشود و در نتیجه گرفتن یک الکترون برای تکمیل کردن لایه آخر، آسانتر از دادن الکترون میشود.
استثنا: گازهای نجیب تمایل به واکنش کمی دارند و کلاً الکترونگاتیوی برای آنها تعریف نمیشود. لانتانیدها و اکتینیدها هم از دو قانون بالا پیروی نمیکنند.
- لینک دانلود فایل بلافاصله بعد از پرداخت وجه به نمایش در خواهد آمد.
- همچنین لینک دانلود به ایمیل شما ارسال خواهد شد به همین دلیل ایمیل خود را به دقت وارد نمایید.
- ممکن است ایمیل ارسالی به پوشه اسپم یا Bulk ایمیل شما ارسال شده باشد.
- در صورتی که به هر دلیلی موفق به دانلود فایل مورد نظر نشدید با ما تماس بگیرید.
 دانش آنلاین | وب سایت علمی پژوهشی
دانش آنلاین | وب سایت علمی پژوهشی

